Nature Genetics | 陈志翔与合作者开发p300/CBP降解剂靶向H2B乙酰化增强子组,为前列腺癌治疗开辟新方向
转录因子驱动的异常增强子组(enhanceosome)构成前列腺癌——尤其是去势抵抗性前列腺癌(CRPC)的核心分子特征。雄激素受体(AR)与ERG等致癌转录因子往往通过重塑染色质、激活增强子来驱动癌基因表达。然而,增强子活化依赖表观遗传因子的协同作用,其中乙酰转移酶p300和其同源蛋白CBP(CREB-binding protein)尤为关键。如何在治疗上有效抑制这些“增强子共激活因子”一直是药物研发的难题。
2025年10月3日,密歇根大学转化病理学中心(MCTP)Arul M. Chinnaiyan教授团队与药物化学家王少萌教授团队的合作在Nature Genetics杂志发表题为Targeting histone H2B acetylated enhanceosomes via p300/CBP degradation in prostate cancer研究成果(https://www.nature.com/articles/s41588-025-02336-6)。该研究由MCTP研究员罗杰(Jie Luo)、陈志翔(Zhixiang Chen,现为中国科学院上海有机化学研究所生物与化学交叉研究中心研究员)、乔源远 (Yuanyuan Qiao) 作为共同第一作者,系统揭示了前列腺癌中的关键表观遗传依赖,并开发了新型p300/CBP降解剂,为“增强子成瘾”型肿瘤提供了全新的精准治疗策略。该成果同时被Nature Genetics杂志选为Research Briefing进行专文报道(https://www.nature.com/articles/s41588-025-02354-4)。

重要发现:H2BNTac是前列腺癌的表观遗传标志
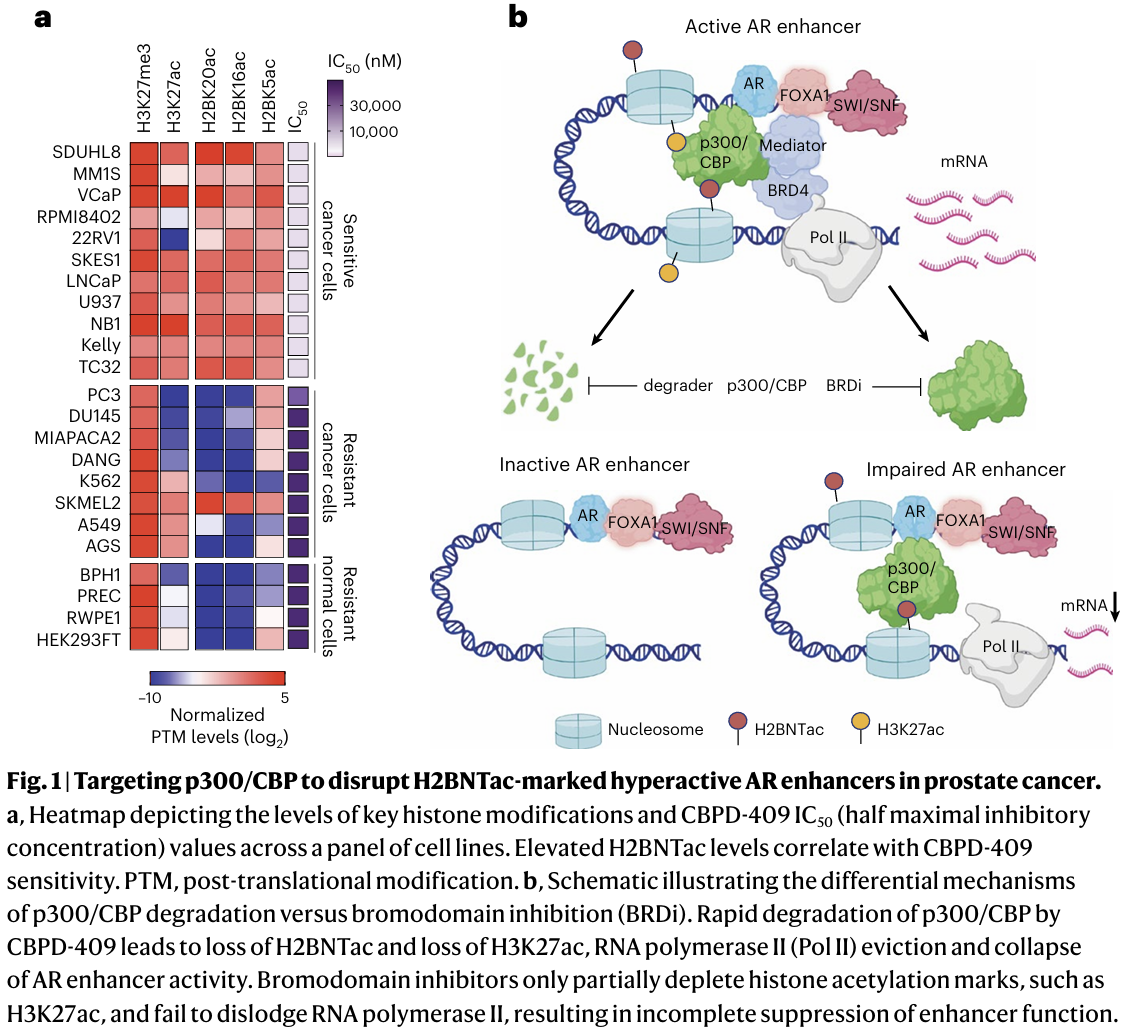
研究团队首次发现,p300/CBP介导的组蛋白H2B氮端多位点乙酰化(H2BNTac)在AR阳性的前列腺癌中显著升高,并成为异常增强子活化的标志性特征。通过免疫荧光染色与组学分析,研究者证实H2BNTac与肿瘤组织高度相关,而在正常前列腺组织中几乎缺失。更重要的是,依赖性分析表明,AR阳性的前列腺癌细胞对p300的依赖性极强,而AR阴性细胞则不依赖,揭示了这一机制的特异性。
p300:AR活性的决定性因子
进一步的ChIP-seq和功能分析显示,p300与AR、ERG在癌细胞增强子位点高度共占位,并赋予这些增强子更高的染色质可及性和转录输出。相比单独的AR结合位点,AR/p300共占位的增强子往往形成超级增强子,驱动MYC、NKX3-1、CCND1等关键癌基因表达。因此,p300不仅是催化乙酰化的酶,更是AR转录活性的“决定性因子”。
创新策略:双重降解胜过抑制
已有的p300/CBP抑制剂进入临床,但其作用有限,无法彻底消除 H2BNTac。为解决这一问题,研究团队开发了CBPD-409—一种基于 PROTAC 技术的口服小分子降解剂(https://pubs.acs.org/doi/10.1021/acs.jmedchem.3c01789)。与抑制剂相比,CBPD-409能快速、选择性且彻底地同时清除p300与CBP,从而消除H2BNTac与H3K27ac信号,全面抑制AR驱动的致癌转录程序。
实验效果:强效抑癌与良好安全性
在体外实验中,CBPD-409对AR阳性的前列腺癌细胞展现出远优于溴结构域抑制剂和HAT抑制剂的杀伤效果,且能克服对传统药物耐药的细胞模型。在超过900种肿瘤细胞系的大规模筛选中,AR阳性前列腺癌细胞对p300/CBP降解剂最为敏感,而神经内分泌前列腺癌和正常细胞则几乎不受影响,凸显了该药物的优异选择性。在动物模型中,系统给药CBPD-409显著抑制肿瘤生长,并与AR拮抗剂联用产生协同效应。尤为重要的是,长期给药未见明显毒性,提示其在临床应用中可能具有较好的安全窗口。
意义与展望
该研究首次明确提出H2BNTac是增强子成瘾的表观遗传标志,并将p300/CBP双重降解确立为抑制前列腺癌增强子活性的全新方向。与以往单一功能结构域抑制剂相比,这一策略更彻底、更精准,显示出强大的临床转化潜力。这一发现不仅为前列腺癌提供了新的治疗思路,也可能推广至多发性骨髓瘤、神经母细胞瘤等其他依赖增强子的恶性肿瘤类型。
该成果配发的Research Briefing评论强调,这一发现将表观遗传学研究与靶向药物开发紧密结合,为未来“增强子靶向治疗”建立了新范式。
附件下载:

