Nature Communications | 张在荣课题组揭示一类保守的泛素结合模块UBH调控p97/VCP依赖性蛋白质质量控制
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心张在荣研究组在Nature Communications发表研究论文,系统解析了AAA+ ATPase p97/VCP在泛素化蛋白质提取过程中所依赖的关键增强模块。研究发现,长期功能未知的一类含UBX结构域蛋白(如FAF2,FAF1,Ubx2,Ubx3,UBXN3,PUX10等)的螺旋结构域实为一种高度保守的泛素结合螺旋(ubiquitin-binding helix, UBH),其与邻近的UBX结构域共同构成功能性UBH–UBX模块,可显著加强泛素化底物靶向p97/VCP,并最少两倍增强p97/VCP的ATP水解活力与底物去折叠动力,从而保障膜蛋白从磷脂双分子层或其他生物大分子复合物中的高效分离,解决了“仅依靠p97-UFD1L-NPLOC4是否足够从生物大分子复合物中解离底物”的长期争议。
在研究内质网相关降解(ERAD)通路时,张在荣团队通过串联亲和纯化和质谱鉴定到与p97/VCP以及泛素化底物同时结合的衔接蛋白FAF2。接下来的功能实验发现FAF2在众多错误折叠内质网底物的降解过程中是不可缺失的,而缺失FAF2的长螺旋结构域则导致降解显著受阻。进一步的机制实验显示,该长螺旋实际上是一种新型泛素结合结构域(UBH),对K48-linked多聚泛素链具有偏好性,其与UBX结构域一起确保膜蛋白在细胞内被有效分离和降解。
利用体外重建体系,作者证明仅由p97/VCP与其经典辅助因子Ufd1-Npl4组成的复合物并不能有效从脂质环境中抽取泛素化膜蛋白,即便底物携带较长K48-linked的泛素链也不足以驱动提取。而当补入FAF2或其UBH–UBX模块后,p97/VCP的ATPase活性和去折叠活性均显著提升,膜蛋白提取得以有效分离恢复,显示该模块在增强p97功率输出中发挥不可替代的作用。令人关注的是,这类 UBH 结构在不同物种(包括酵母、植物)的UBA-UBX蛋白中均可找到,并在跨物种实验中表现出一致的泛素结合和增强效应,提示其为一类进化保守的“动力增强单元”,起到类似“涡轮增压”的作用。
进一步的细胞实验显示,该模块不仅介入经典的ERAD途径,也参与线粒体相关蛋白的降解,以及过氧化物酶体的稳态维持。FAF2 的UBH缺失会削弱线粒体膜蛋白的降解效率,并导致过氧化物酶体过度被自噬清除。此外,FAF1上的UBH-UBX模块在DNA解旋酶复合体解聚过程中也发挥着关键作用,揭示了这一模块在多条质量控制通路中的广泛功能。
这一研究不仅填补了p97/VCP在膜蛋白降解过程中缺失的“力学环节”,也阐明了UBH-UBX蛋白在泛素依赖通路中的核心调控作用。该成果为理解神经退行性疾病、代谢紊乱以及病毒感染等相关病理状态下的p97/VCP功能异常提供了重要线索,并为未来开发靶向p97/VCP及其适配因子的精确调控策略奠定了理论基础。
研究得到国家自然科学基金委、中国科学院、上海市科委等项目资助,并得到中国科学院上海有机化学研究所张耀阳课题组、潘李锋课题组大力支持。
原文链接:https://www.nature.com/articles/s41467-025-65166-4
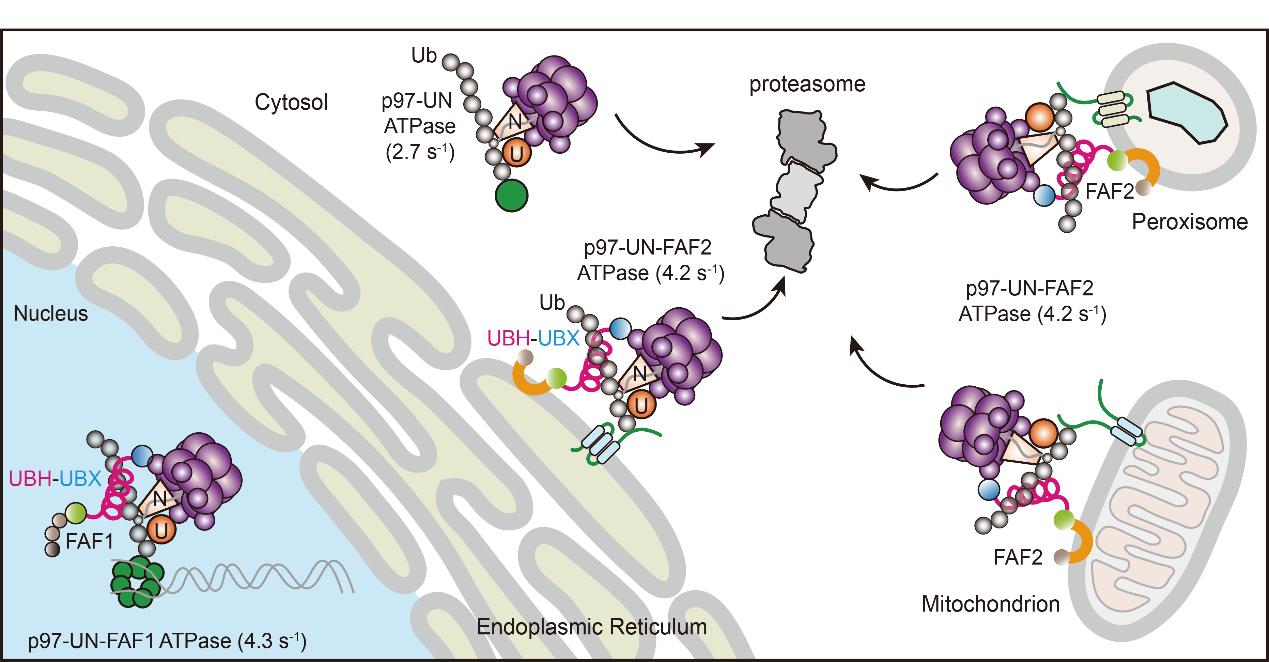
FAF2和FAF1调控多种细胞器稳态和DNA复制体解聚的作用机制模式图
附件下载:

