Cell Chem Biol | 张耀阳课题组开发lcFAX方法揭示TRIM28介导的SUMO化修饰调控应激颗粒动态性新机制
无膜细胞器是由蛋白质和RNA等分子通过液-液相分离形成的动态细胞结构。它们可在细胞内快速组装与解聚,为分子反应提供局部浓缩与调控环境,在应激响应、基因表达、信号转导及蛋白质稳态维持等过程中发挥关键作用。典型的无膜细胞器包括应激颗粒(stress granules)、P bodies、核仁以及转录调控凝聚体等。由于这些结构具有高度动态性、可逆性及复杂的分子组成,传统生化方法难以精确捕获其瞬态相互作用与修饰状态,因此对其系统性解析一直面临显著技术挑战。

为应对这一挑战,近日,中国科学院上海有机化学研究所生物与化学交叉研究中心张耀阳研究员课题组在Cell Chemical Biology期刊发表题为“TRIM28-Mediated SUMOylation of G3BP1/2 Regulates Stress Granule Dynamics”的研究论文。该研究开发了低浓度甲醛交联质谱(low-concentration formaldehyde crosslinking mass spectrometry, lcFAX-MS)方法,以简便、快速的方式稳定无膜细胞器,显著增强了下游的蛋白质组与转录组分析。利用该方法,研究团队首次揭示了TRIM28介导的G3BP1/2 SUMO化修饰在应激颗粒动态调控中的关键作用及其分子机制(图1)。
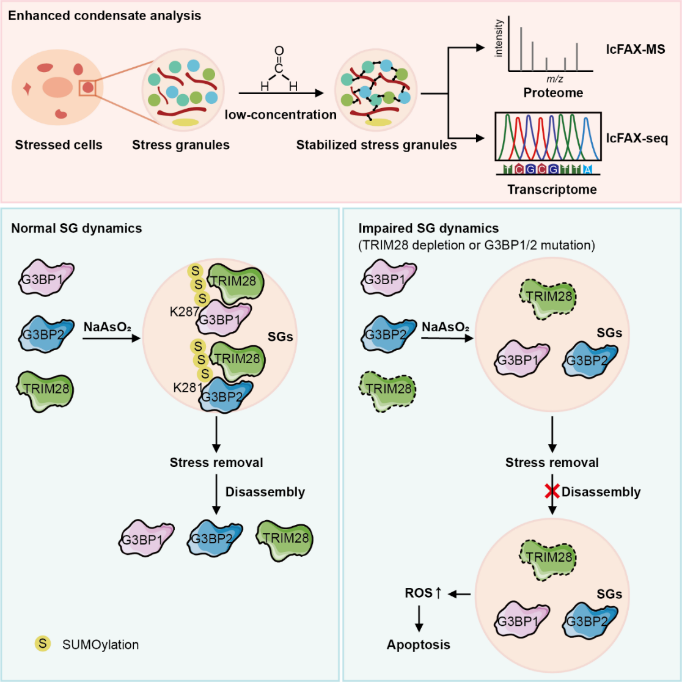
图1. lcFAX-MS方法的建立及TRIM28介导的SUMO化修饰调控应激颗粒动态性的分子机制。
甲醛是一种常用的交联试剂,通常采用1–4%浓度,该浓度容易导致过度交联、蛋白沉淀或细胞死亡,不利于后续分析。研究团队创新性地采用低浓度(0.05%)甲醛交联策略,既能有效稳定SG,又避免额外应激与过度交联,并与后续富集和质谱分析高度兼容。结合定量蛋白质组学,开发了lcFAX-MS方法,利用该方法共鉴定出504个候选SG蛋白,数量显著高于以往报道。
其中,TRIM28是此前未被报道的SG相关蛋白,可与应激颗粒的核心组分G3BP1/2相互作用。通过FRAP实验,研究人员发现TRIM28显著影响SG解聚的动态性,提示其在SG稳态调控中的重要作用。由于TRIM28具有E3 SUMO连接酶活性,而SG的组装与解聚受多种翻译后修饰调控,研究进一步通过质谱与突变实验发现,TRIM28可介导G3BP1的K287位点与G3BP2的K281位点发生SUMO化修饰。这是首次在G3BP1/2上明确报道的SUMO修饰位点,该修饰可调控SG解聚并抑制G3BP1/2的泛素化,从而阻止其通过蛋白酶体途径降解。蛋白质组学分析提示,该修饰可能影响线粒体功能,进而调节细胞氧化应激与凋亡,为理解SG与细胞命运调控的联系提供了新视角。
此外,研究团队还将lcFAX方法拓展至转录组分析(lcFAX-seq)。与传统RIP-seq相比,lcFAX-seq可鉴定更多、更可靠的SG候选RNA,结果显示已知SG相关RNA(如AHNAK-1与ATF4)的富集显著增强,整体候选RNA特征更符合SG转录组的已知规律。
综上,本研究不仅阐明了TRIM28介导的G3BP1/2 SUMO化在应激颗粒动态调控中的关键分子机制,还建立了一种适用于多种无膜细胞器研究的通用交联分析策略,为解析液-液相分离相关生物过程提供了新的工具与思路。
本研究第一作者为中国科学院上海有机化学研究所生物与化学交叉研究中心博士研究生袁艺。项目得到国家自然科学基金、中国科学院及上海市科委的资助。Cell Chemical Biology同期刊发“Meet the Authors”专题,对研究团队及其背后的科研故事进行了深入报道。
文章链接:https://doi.org/10.1016/j.chembiol.2025.10.003
附件下载:

