
-
中文 | EN

中文 | EN
发布时间:2023-07-03 00:00:00.0
腺苷单磷酸活化蛋白激酶(AMPK)活性被刺激以促进能量应激下的代谢适应。然而,持续的代谢应激可能导致细胞死亡。AMPK决定细胞死亡的机制尚不完全清楚。
2023年6月29日,中国科学院生物与化学交叉研究中心袁钧瑛、许代超课题组、哈佛医学院魏文毅、中国科学院上海有机所潘李峰课题组、及美国索尔克生物研究所Reuben J. Shaw共同通讯在Science在线发表题为“Metabolic orchestration of cell death by AMPK-mediated phosphorylation of RIPK1”的研究论文,该研究表明代谢应激促进了TRAIL受体介导的受体相互作用蛋白激酶1 (RIPK1)的激活,而AMPK通过在Ser415位点磷酸化抑制RIPK1以抑制能量应激诱导的细胞死亡。
通过Ampk缺失或RIPK1 S415A突变抑制pS415-RIPK1可促进RIPK1的激活。此外,RIPK1基因失活对髓系Ampkα1缺陷小鼠的缺血性损伤有保护作用。该研究表明,AMPK磷酸化RIPK1代表了一个重要的代谢检查点,它决定了细胞对代谢应激的命运反应,并强调了AMPK-RIPK1轴在整合代谢、细胞死亡和炎症中的作用。

腺苷磷酸(AMP)激活的蛋白激酶(AMPK)是一种进化上保守的细胞营养状态传感器和真核生物能量稳态调节剂。细胞内AMP的增加总是伴随着三磷酸腺苷(ATP)的减少,AMPK被激活并作为代谢检查点。然而,当广泛的代谢应激超过AMPK介导的适应时,它会激活细胞死亡。AMPK在代谢应激下调节细胞存活的机制尚不完全清楚。
受体相互作用蛋白激酶1 (RIPK1)是细胞死亡和炎症的关键介质。在肿瘤坏死因子-α (TNFα)刺激肿瘤坏死因子受体1 (TNFR1)时,激活的RIPK1可能介导受体相互作用蛋白激酶3 (RIPK3)和混合谱系激酶结构域样(MLKL)依赖的坏死坏死或caspase-8依赖的凋亡。RIPK1也在Fas死亡受体(也称为CD95)、TRAIL受体1 (TRAIL-R1,也称为DR4)和TRAIL-R2(也称为DR5)的下游被激活,除了TNFR。值得注意的是,抑制RIPK1的激活在防止缺血性损伤方面非常有效。然而,RIPK1是否以及如何在缺血条件下被激活尚不清楚。
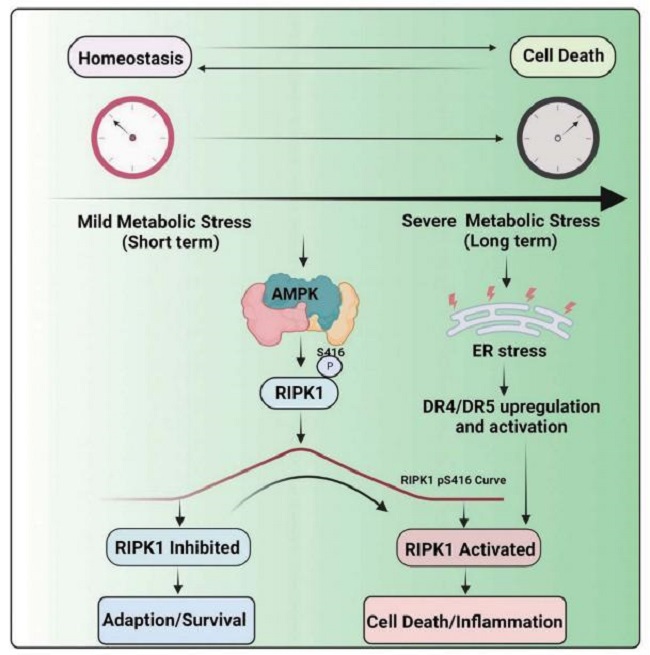
该研究表明,磷酸化调控RIPK1活性能够在代谢应激反应中控制细胞死亡和炎症。与AMPK的其他底物平行,AMPK通过磷酸化直接抑制RIPK1,进而抑制能量应激诱导的细胞死亡和炎症。该研究揭示了RIPK1对代谢应激的微妙和短暂的细胞反应:细胞激活AMPK来抑制RIPK1的激活,允许在能量应激下短期存活,而从长远来看,当RIPK1的AMPK磷酸化丢失时,抑制被缓解,促进激活RIPK1介导的细胞死亡和炎症的转换。该研究提出的工作扩展了人们对代谢和细胞死亡调节之间相互作用的理解,这些结果也证实了RIPK1在缺血引起的细胞死亡中的作用,从而暗示AMPK-RIPK1相互作用是潜在的治疗靶点,这可能有助于开发旨在预防缺血诱导的细胞死亡和组织损伤的治疗药物。
该工作受到了国家重点研发计划,国家自然科学基金委,中科院先导专项,和上海市科委的资助。
原文链接:
https://www.science.org/doi/10.1126/science.abn1725
