
-
中文 | EN

中文 | EN
发布时间:2024-03-18 00:00:00.0
近日,刘聪课题组与复旦大学附属华山医院王坚课题组在Cell Discovery杂志在线发表题为“Cryo-EM structures reveal variant Tau amyloid fibrils between the rTg4510 mouse model and sporadic human tauopathies”的研究论文。本研究首次从科研常用的Tau蛋白病小鼠模型(rTg4510)中提取Tau病理淀粉样纤维,并通过冷冻电镜解析其原子结构。通过结构比对,发现模型小鼠中的Tau纤维与Tau蛋白病(如:阿尔兹海默病及进行性核上性麻痹等)患者脑内的病理性纤维结构存在明显的差异。本工作强调了对于临床病理高度异质性的神经退行性疾病,在分子原子层面上对病理蛋白聚集进行精准分子分型的重要性;也提示了需要谨慎审视运用Tau及Abeta等聚集制造的不同疾病小鼠模型进行神经退行性疾病病理机制研究及药物筛选的合理性与可靠性。

Tau蛋白的错误折叠与聚集是阿尔茨海默病(AD),额颞叶痴呆(FTLD)和进行性核上性麻痹(PSP)等一些列神经退行性疾病的共同病理特征,这类疾病被统称为Tau蛋白病。近年的一系列研究表明,提取自不同类型Tau蛋白病患者大脑的Tau淀粉样纤维具有不同的原子结构,这暗示了Tau淀粉样纤维结构与Tau蛋白病异质性的紧密联系,表明Tau淀粉样纤维的结构对于理解不同Tau蛋白病的病理机制至关重要。
动物模型是疾病致病机制研究和新型药物研发的重要工具。鉴于Tau蛋白在系列神经退行性疾病中的关键作用,一些过表达突变Tau蛋白的小鼠已被建立,被广泛用于AD和FTLD等疾病的机制研究和药物开发。长期以来,诸多药物分子在动物模型上颇有成效,但在进入临床实验却以失败告终,这使研究者对相关的疾病动物模型能否准确模拟Tau蛋白病产生疑问。
针对这一关键科学问题,本研究中,研究者直接抽提了来自rTg4510小鼠(过表达携带了家族性FTLD相关突变P301L的Tau蛋白,是目前最常用的Tau病理模型之一)大脑的Tau淀粉样纤维,并进一步通过冷冻电镜技术解析了Tau纤维的原子结构。通过与患者大脑来源的Tau淀粉样纤维进行结构比对,研究者发现,虽然来自rTg4510小鼠的 Tau纤维与患者脑源性Tau纤维共享一个U型结构域,但并不能完全复现既往报道的任何一种患者来源的Tau纤维结构,且进一步的结构分析表示,这种结构的差异在一定程度上受到了P301L突变的影响。
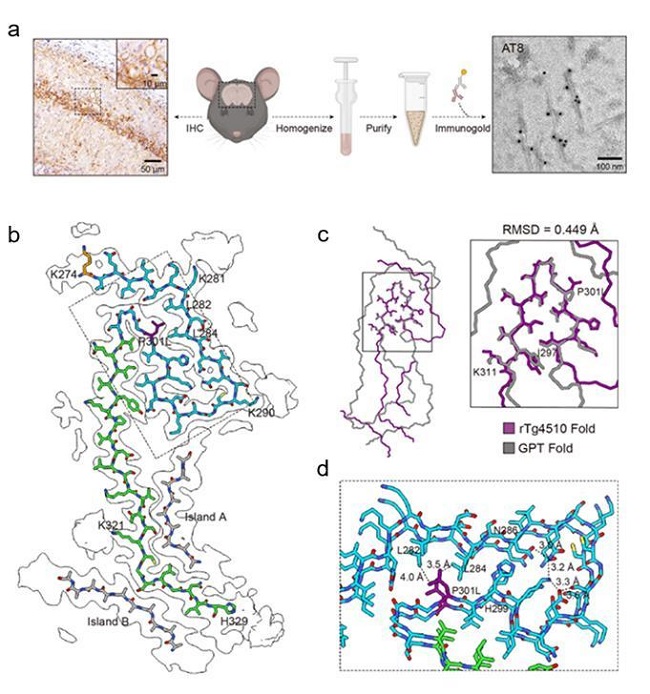
图:rTg4510小鼠 Tau 淀粉样纤维表征和cryo-EM结构
这项工作表明,rTg4510小鼠无法在原子和分子层面精确模拟散发型Tau蛋白病。这种致病纤维构象上的差异对于相关靶向药物以及正电子发射断层扫描(PET)成像示踪剂的开发会产生较大的影响,尤其是候选药物从动物模型向临床的转化成功率。在未来的工作中,研究人员需要对已有Tau蛋白病动物模型进行原子水平的鉴定和分型,并进一步开发能在分子和原子水平准确复现Tau蛋白病的小鼠模型。研究者需要根据动物模型在原子水平上的复刻程度,对动物模型的适用场景进行分类,以保证实验数据的可用性。另外,在Tau蛋白病动物模型的开发中,引入家族性疾病突变是诱导加重Tau病理的普遍方式,但病理性突变的引入可能会在很大程度上降低其对散发型的Tau蛋白病中Tau聚集体结构的模拟与复刻。因此,更合理的动物模型开发策略还有待探究。
该研究由刘聪课题组与复旦大学附属华山医院王坚课题组共同完成。复旦大学附属华山医院王坚课题组研究生赵婉冰,中国科学院生物与化学交叉研究中心刘聪课题组研究生刘凯恩,和复旦大学附属华山医院已毕业博士研究生范云为文章的共同第一作者,刘聪研究员和王坚教授为本文共同通讯作者。该工作受到了国家自然科学基金委,上海市科委和中国科学院等项目资助。
原文链接:https://www.nature.com/articles/s41421-023-00637-w
