
-
中文 | EN

中文 | EN
发布时间:2025-09-28 00:00:00.0
免疫衰老是机体衰老过程中免疫系统发生的多维度功能衰退,涉及造血干细胞分化异常、胸腺萎缩、系统性炎症升高及适应性免疫应答减弱等关键变化。其中,T细胞衰老被视为驱动免疫系统功能下降的核心环节,与老年人感染易感性增加、疫苗应答效率降低及肿瘤发生率上升密切相关。
细胞外基质作为细胞微环境的重要组成,其结构与成分变化对细胞功能具有深远影响。其中糖萼作为贴近细胞膜表面的基质组分,由糖蛋白、糖脂等构成,参与细胞信号转导并调控T细胞的发育、稳态维持、活化及耗竭等过程。然而,胞外基质包括糖萼组分在衰老过程中的调控作用尚不明确。2025年9月26日,加州大学伯克利分校和霍华德休斯医学研究所的张汉林(现为中国科学院上海有机化学研究所生物与化学交叉研究中心新聘研究员)和合作者在《Science Advances》上发表研究,以T细胞衰老作为模型,揭示了年龄相关的唾液酸糖基化修饰缺失如何抑制CD8+ T细胞功能,为理解胞外微环境在免疫衰老中的作用提供了新机制。

本研究首先检测了不同年龄小鼠体内免疫细胞的糖基化变化,发现衰老个体的CD8⁺ T细胞中α2,6-连接唾液酸显著减少,暗示其可能与T细胞功能衰退相关。而且这种减少并非由于T细胞类群携带修饰的整体下调,而是源于衰老小鼠体内出现了一个几乎不携带唾液酸修饰的新型T细胞亚群(SNAlow),该亚群比例随年龄增长而上升(图1)。进一步表型分析实验表明,T细胞活化可诱导SNAlow群体的产生,而且SNAlow CD8⁺ T细胞主要为短时程效应T细胞,而SNAhigh群体则多为长寿记忆T细胞。
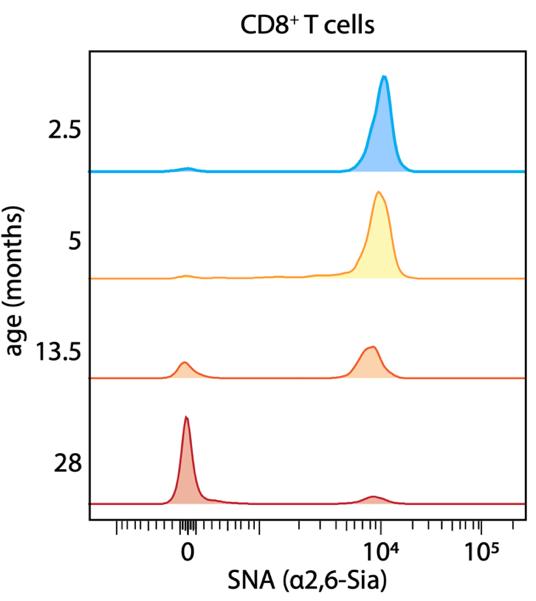
图1. 不同年龄小鼠体内CD8+ T细胞的唾液酸变化(源自论文)
为探究两群体间的发育关系,研究人员进行了体内移植重构实验,发现SNAhigh可高效、单向转化为SNAlowT细胞,这说明SNAhigh具有较强干性,而SNAlow则已进入终末分化阶段。
机制上,RNA测序显示SNAhigh群体中唾液酸转移酶基因St6gal1表达显著高于SNAlow,这说明St6gal1表达下降是导致α2,6-唾液酸缺失的直接分子原因。研究人员进一步构建了T细胞特异性St6gal1敲除小鼠,通过功能实验证实基因敲除的CD8⁺ T细胞在体内外活化能力均显著降低。
由于T细胞功能减退(如耗竭)与肿瘤等持久性免疫反应紧密相关,研究人员测试了St6gal1-KO T细胞在MC38肿瘤移植模型中控制肿瘤生长的能力。结果表明St6gal1缺失小鼠体内的肿瘤生长更快,且PD-1抗体可部分恢复T细胞功能(图2)。该结果暗示α2,6-连接唾液酸修饰对T细胞功能的调控可能涉及对相关激活/抑制性信号通路平衡的调节,但具体受到调控的受体及通路仍有待明确鉴定。
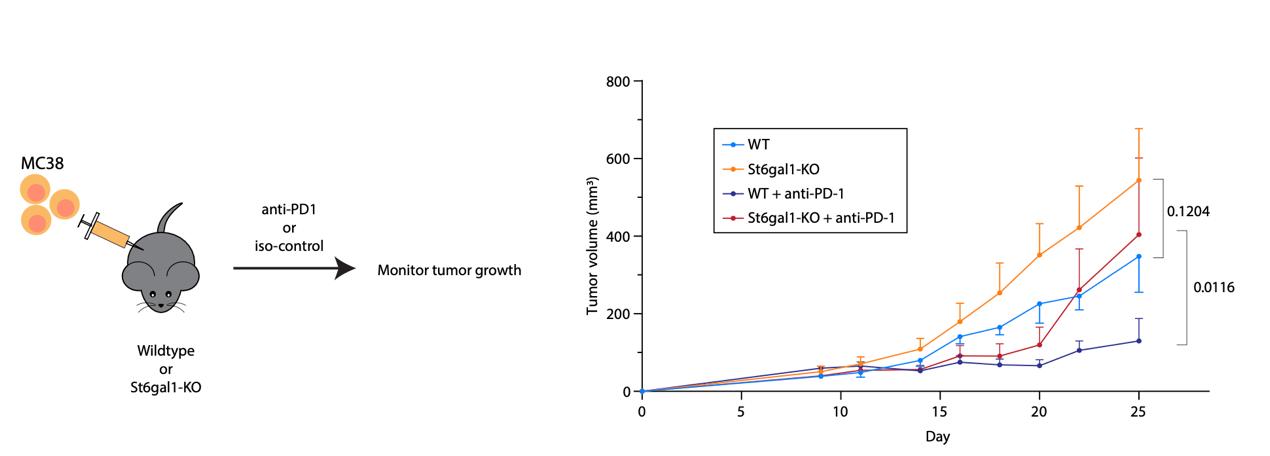
图2. α2,6-连接唾液酸的丢失导致T细胞抗肿瘤能力减弱(源自论文)
本研究以免疫细胞作为模型研究了胞外糖基化修饰对生物衰老过程的调控。借助免疫衰老模型,揭示了α2,6-连接唾液酸的年龄相关性缺失是调控T细胞功能衰退的新机制(图3)。该发现也对肿瘤免疫治疗具有重要启示:虽然靶向肿瘤细胞唾液酸以破除免疫逃逸是当前的临床测试方向,但本研究提示唾液酸对于维持T细胞自身持久或高效的抗肿瘤功能同样至关重要。因此,未来的治疗策略需审慎平衡对肿瘤和免疫细胞的不同影响,避免因长期去除唾液酸而导致的免疫功能损伤。
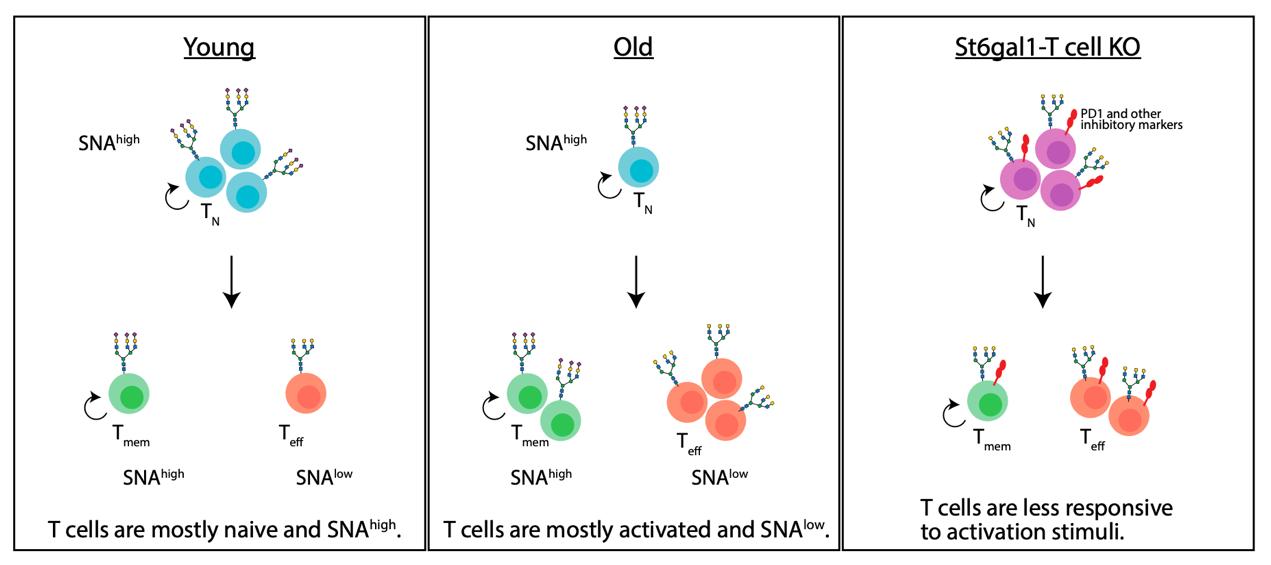
图3. 发现总结示意图(源自论文)
中国科学院生物与化学交叉研究中心张汉林研究员为本文共同第一作者,加州大学伯克利分校和霍华德休斯医学研究所Andrew Dillin教授为本文通讯作者。来自交叉中心的研究生杨泽玺同学参与了该新闻稿的写作。张汉林研究员长期关注衰老分子机制的鉴定和转化研究,主要研究方向包括免疫衰老、细胞蛋白及代谢稳态维持、胞外基质重塑等方面,欢迎对相关研究感兴趣的同行与作者交流联系。
原文链接:https://www.science.org/doi/10.1126/sciadv.adw6755
