
-
中文 | EN

中文 | EN
发布时间:2021-09-23 00:00:00.0
在细胞中,蛋白质作为执行生物学功能的基本单元,可以通过液-液相分离组装成各类无膜细胞器以执行更加复杂的功能。这些无膜细胞器种类繁多且广泛分布在不同类型的细胞中1。研究表明无膜细胞器具有独特的物理化学性质,它们在胞内通常处在高度动态的组装与解离过程。该过程在细胞内受到精密的动态调控。在疾病条件下,无膜细胞器的动态调控发生紊乱,这会导致其内部高浓度的蛋白发生病理性液-固相转化。该过程与多种神经退行性疾病的发病密切相关2。那么,细胞通过什么机制来对不同的无膜细胞器进行动态调控并有效抑制病理性蛋白聚集的呢?
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪课题组与上海交通大学Bio-X研究院李丹课题组长期关注分子伴侣在蛋白质稳态维持中的功能。两个课题组与多方携手合作,发现了一系列在无膜细胞器动态调控中起重要作用的分子伴侣(如Hsp40,Hsp27,Hsp70以及NMNAT等3-6)。此类研究逐步揭示了以分子伴侣调控网络为核心的胞内无膜细胞器动态调控机制。基于以上的工作积累,刘聪与李丹受邀为Trends in Cell Biology撰写了题为“Spatiotemporal dynamic regulation of membraneless organelles by chaperone networks”的前沿综述文章(forum)。该文章系统总结了近三年在本领域发表的代表性工作,并在此基础上,提出了分子伴侣是通过形成空间上广泛分布的、时间上多层调节的复杂网络,来动态调控不同无膜细胞器的理论观点。最后,作者进一步探讨了通过调控分子伴侣网络重塑无膜细胞器动态平衡来抑制蛋白病理性聚集的方法,为相关神经退行性疾病的药物研发提供了新的思路。

该文章首先汇总了近期报道的分子伴侣通过不同方式动态调控蛋白相变的经典案例。如分子伴侣Kapβ2、Hsp27、Hsp40能够协同调控FUS蛋白相分离或相转化过程。并且由于这些分子伴侣具有不同的生化性质,它们调控FUS蛋白相变的方式也各具特点(图1)。另外,翻译后修饰可能通过直接改变分子伴侣的生化性质来改变其调控相变的方式。如在应激条件下,Hsp27的氨基端多个位点发生磷酸化修饰,修饰后Hsp27抑制FUS相分离能力减弱,但其抑制FUS淀粉样聚集的能力增强。
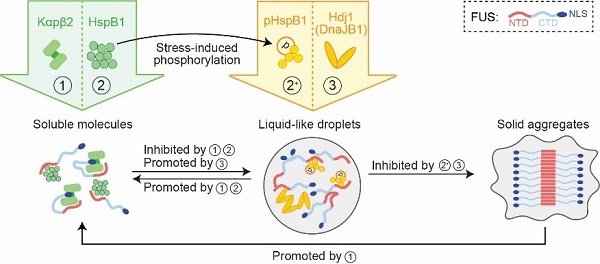
图1 性质、功能各异的分子伴侣协同调控FUS蛋白的相变过程
进一步,作者提出了分子伴侣通过组成复杂的网络,来实现对空间上不同种无膜细胞器,以及同种但时间上处于不同阶段的无膜细胞器的动态调控。已知分子伴侣广泛分布于不同种类的无膜细胞器中。但在细胞中,参与不同无膜细胞器组装的分子伴侣的种类和功能却有较大不同(图2A)。另外,在以应激时程或病理进程为衡量标准的时间尺度上,不同阶段应激颗粒同样能够招募不同种类和功能的分子伴侣,以实现应激颗粒复杂的动态调控(图2B)。
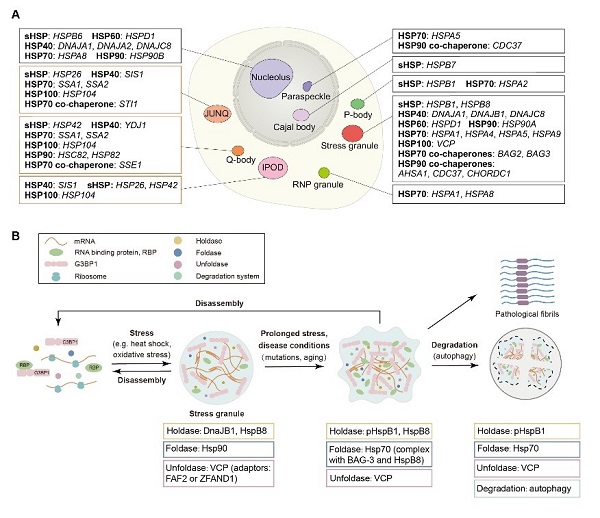
图2 分子伴侣介导的无膜细胞器的时空调控网络
最后,作者总结了分子伴侣调控网络受损与特定神经退行性疾病发病的联系,提出了可以通过调控分子伴侣网络来重塑无膜细胞器动态平衡,抑制致病蛋白病理性聚集的策略,为实现相关神经退行性疾病的干预和治疗提供新的思路。
参考文献
1. Banani, S.F., Lee, H.O., Hyman, A.A. & Rosen, M.K. Biomolecular condensates: organizers of cellular biochemistry. Nature reviews. Molecular cell biology 18, 285-298 (2017).
2. Alberti, S. & Hyman, A.A. Biomolecular condensates at the nexus of cellular stress, protein aggregation disease and ageing. Nature reviews. Molecular cell biology 22, 196-213 (2021).
3. Gu, J. et al. Hsp40 proteins phase separate to chaperone the assembly and maintenance of membraneless organelles. Proceedings of the National Academy of Sciences of the United States of America 117, 31123-31133 (2020).
4. Liu, Z. et al. Hsp27 chaperones FUS phase separation under the modulation of stress-induced phosphorylation. Nature structural & molecular biology 27, 363-372 (2020).
5. Gu, J. et al. Hsp70 chaperones TDP-43 in dynamic, liquid-like phase and prevents it from amyloid aggregation. Cell research (2021).
6. Ma, X. et al. Nicotinamide mononucleotide adenylyltransferase uses its NAD(+) substrate-binding site to chaperone phosphorylated Tau. Elife 9 (2020).
论文链接:https://www.cell.com/trends/cell-biology/fulltext/S0962-8924(21)00165-3
