
-
中文 | EN

中文 | EN
发布时间:2024-03-29 00:00:00.0
近日,刘聪课题组与清华大学化学系李艳梅课题组合作在Nature Communications杂志上发表了题为“Phosphorylation and O-GlcNAcylation at the same α-synuclein site generate distinct fibril structures”的研究论文。本研究利用半化学合成的优势,研究疾病相关的同一位点(S87)的糖基化和磷酸化对α-synuclein (α-syn)蛋白聚集能力、纤维结构和神经病理学的影响。

病理性的淀粉样蛋白聚集是神经退行性疾病的关键病理标志,例如α-syn蛋白沉积是帕金森病中路易小体和路易神经突的主要成分。目前已报道α-syn在体内存在多种翻译后修饰,包括磷酸化(Y39、S87、S129等)、糖基化(T72、T75、S87等)、泛素化、乙酰化等,这些翻译后修饰可以调控其聚集动力学、纤维结构和神经毒性等。然而,目前关于α-syn蛋白同一位点的不同翻译后修饰的影响效果依然没有得到充分阐释,也缺乏相应的结构生物学研究进行原子水平的解释。
针对这一科学问题,在本研究中,研究者首先结合蛋白表达和化学合成的优势,合成了高纯度的S87位点特异性O-糖基化(gS87)和磷酸化(pS87)修饰的α-syn蛋白。ThT荧光动力学、负染电镜和原子力显微镜等表征实验发现,糖基化和磷酸化会严重抑制α-syn蛋白的纤维化,并且诱导产生形态不同于野生型的α-syn纤维。基于冷冻电镜三维重构技术,研究人员解析了gS87和pS87 α-syn的淀粉样纤维结构,分别获得了3.1 Å和2.6 Å的高分辨率电子密度图。
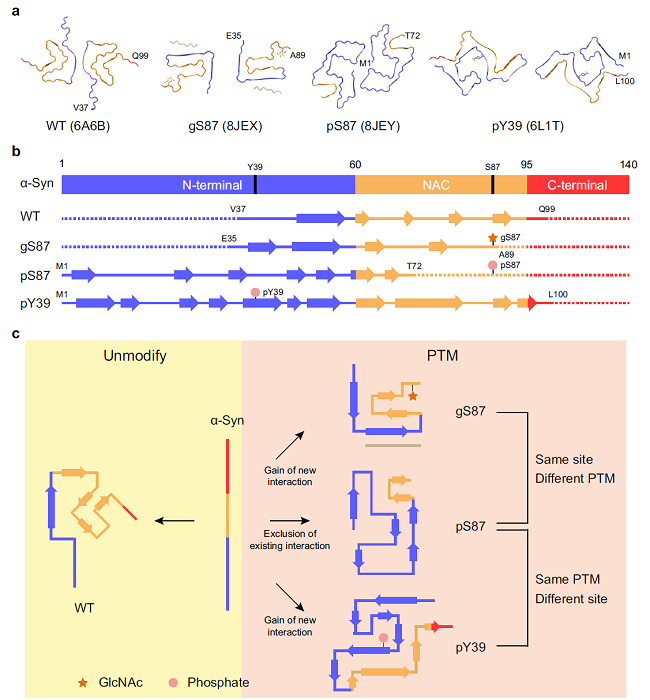
如图所示,搭建的原子模型显示:gS87和pS87 α-syn纤维都形成了不同于野生型的全新结构,其中,在gS87纤维核心中单个α-syn分子折叠成熨斗状,其可见氨基酸序列为E35至A89,在第87位丝氨酸附近可以观察到明显的糖基GlcNAc的电子云密度,结构分析发现其与周围氨基酸有直接的相互作用,并且与GlcNAc互作的K80与E61形成盐桥,进一步稳定了gS87 α-syn纤维构象。不同的是,同一位点被磷酸化修饰后,pS87 α-syn纤维可见氨基酸残基是M1至T72,而磷酸化的S87并没有参与形成纤维核心,而是保持着相对灵活的构象,并且其结构也不同于之前报道的pY39纤维。同时,细胞实验表明,与野生型α-syn PFF处理组相比,gS87和pS87 α-syn PFF处理组中病理性α-syn pS129的荧光信号显著减少,并且神经元的存活率更高,这表明S87位的糖基化和磷酸化降低了α-syn纤维的传播活性和神经毒性。
综上所述,糖基化和磷酸化修饰S87位后,极大的减弱了α-syn蛋白的聚集能力,并诱导产生了不同于野生型的全新构象;同时降低了α-syn纤维的传播活性和细胞毒性。该研究揭示了不同种类的翻译后修饰(同一位点或者不同位点)调控淀粉样纤维结构与毒性的高度复杂性,同时阐述了翻译后修饰的α-syn在帕金森病中的作用,而翻译后修饰诱导产生的结构与被改变的神经病理之间的直接关系,有待于进一步的研究。
本研究由刘聪课题组和清华大学化学系李艳梅课题组合作共同完成,刘聪研究员和清华大学化学系李艳梅教授为论文的共同通讯作者;清华大学化学系李艳梅课题组博士生胡津健、中国科学院生物与化学交叉研究中心刘聪课题组博士生夏文程、上海交通大学Bio-X研究院博士生曾姝怿和清华大学化学系李艳梅课题组博士生林业竣为文章的共同第一作者。该工作得到了来自于国家自然科学基金委、科技部及上海市科委等项目及基金的资助。
