
-
中文 | EN

中文 | EN
发布时间:2024-04-04 00:00:00.0
机械力信号在生活中无处不在,参与介导多种感知觉的形成,比如手指触摸书本产生触觉,声波传递到耳内引起震动产生听觉。这些机械力信号的感知与传导主要通过机械力敏感离子通道来完成。机械力信号能够激活这些通道,从而允许离子通过,将机械力信号转化为电化学信号,通过下游信号传导介导多种重要的生理活动。OSCA/TMEM63家族是目前已知的最大的一类机械力敏感离子通道家族,在植物和动物界中均承担着重要的生理功能,比如逆境响应、听觉、渴觉及湿度感知等1-5。但是OSCA/TMEM63家族蛋白是如何被机械力激活打开的,其分子机制并不清楚,主要原因在于想要在结构解析的过程中模拟机械力环境非常困难,这也是机械力通道研究领域的一大技术难点。
2024年4月3日,中科院上海有机化学研究所生物与化学交叉研究中心张一小课题组联合澳大利亚Vitor Chang心脏研究所Charles Cox课题组以及澳大利亚国立大学Ben Corry课题组在Nature上发表了题为Mechanical activation opens a lipid-lined pore in OSCA ion channels的文章,通过将OSCA蛋白组装到纳米磷脂盘及脂质体中模拟机械力环境,捕捉到了OSCA蛋白激活态的三维构象,阐释了其机械力激活的分子机制,并发现了一种全新的有磷脂排列的离子孔道组成形式(图1)。

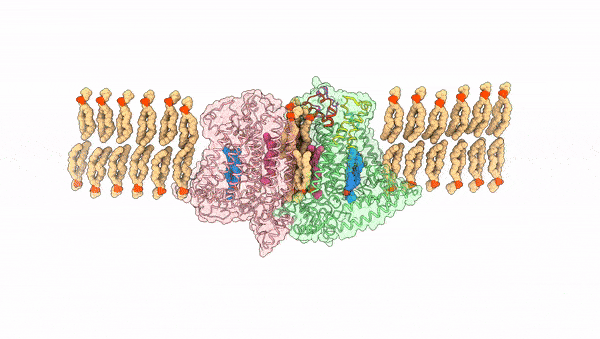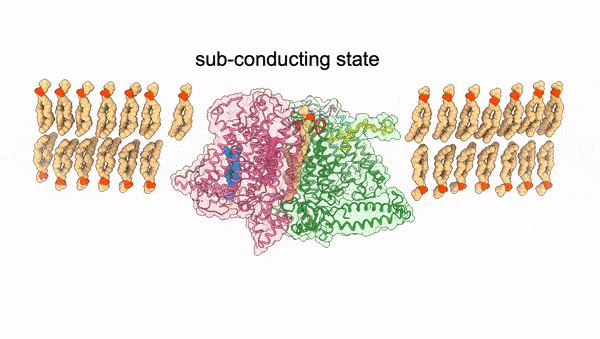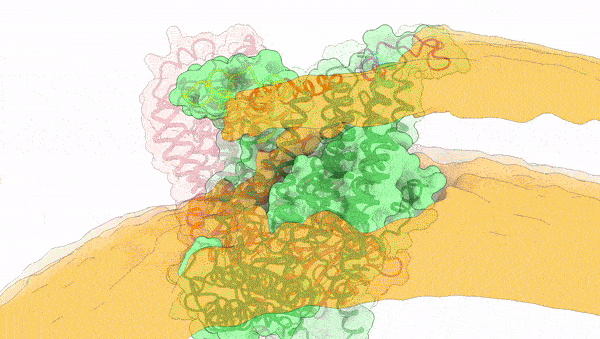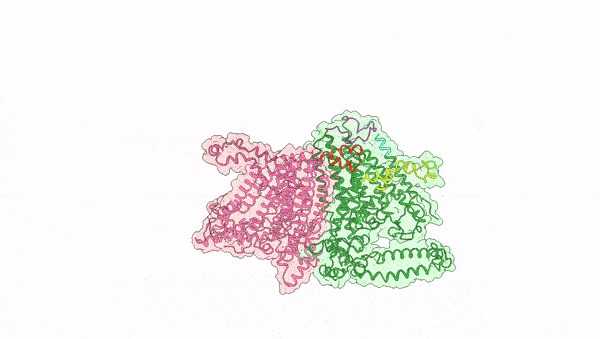
图1. OSCA受机械力激活动态变化过程
本文的主要亮点包括:
1.通过多种不同的策略来捕捉OSCA蛋白激活态的三维构象(图2)
2. 利用纳米磷脂盘发展了一种简单易用的“lipid titration”机械力模拟方法来进行“force-resolved” 的结构研究
3. 实现了分子量小于200kDa的膜蛋白在脂质体中的高分辨三维结构解析
4. 揭示了不同磷脂在OSCA机械力感知过程中的重要作用
5. 发现细胞膜中的磷脂可以通过其headgroup形成“lipid wall”来参与离子孔道的组成
6. 对结构相似的TMC1及TMEM16家族蛋白的分子机制有重要提示作用
在本文的研究中,作者首先尝试将OSCA1.2蛋白组装在纳米磷脂盘中(nanodiscs, 由膜支架蛋白围成的磷脂双分子层小圆盘)并使用β-环糊精抽提其中的脂质来引起剩余脂质的扩张,进而在蛋白周围产生拉力环境。在冷冻电镜的结构解析过程中,作者发现蛋白颗粒高度动态,虽然能够观察到与关闭状态不同的构象变化,但是难以获取清晰的高分辨率三维结构,推测是与环糊精从每个nanodisc中抽取出来的脂质含量不同有关。此时,作者猜想, 如果从一开始组装nanodiscs的时候,就用不同量的磷脂来组装,这样更容易控制每个nanodisc中磷脂的含量,从而可能调节蛋白周围拉力的大小。通过这种“lipid titration”的方法,作者对蛋白构象变化进行了“滴定”,捕捉到了OSCA1.2单侧激活的构象。但是在这个结构中,有两根跨膜螺旋密度缺失,并且离子孔道面向细胞膜有很大的开口,因此无法确认离子通过路径。接下来,作者通过电生理实验验证了曲率变化可以激活OSCA蛋白, 而在之前的研究中,肖百龙教授团队成功的用脂质体与蛋白之间的曲率错配来捕捉Piezo1蛋白在激活态的三维结构,提示了脂质体可以用于其他机械力通道的研究6。但是OSCA蛋白总分子量只有175kDa,并且大部分包埋在细胞膜当中,给结构解析带来了很大困难。作者通过样品的优化,成功将OSCA1.2组装到大小较为均一的脂质体中,并在inside-in的取向中捕捉到了OSCA蛋白完全激活的高分辨三维结构。通过结构分析和电生理实验,揭示了OSCA蛋白机械力感知的关键元件,以及发现二聚化对于稳定OSCA蛋白的激活状态十分重要。可是在此开放构象中,虽然所有的跨膜螺旋都被清晰的解析,但离子孔道仍旧向细胞膜侧有较大的开口。有意思的是,在电镜密度图中作者发现该开口刚好被一段由细胞膜磷脂组成的lipid wall所覆盖。结合分子动力学模拟和电子密度特征,作者发现该lipid wall主要由磷脂的head group构成,而电生理实验也发现改变head group的电性特征,会影响OSCA1.2的离子选择性,进一步支持这一全新的“proteo-lipidic pore”。同时,作者还在OSCA3.1蛋白中发现了多个稳定结合的lipids, 结构研究和电生理实验均发现通过突变移除一个interlocking lipid能够引起OSCA3.1的自发开放,提示了磷脂在机械力感知过程中的重要作用。
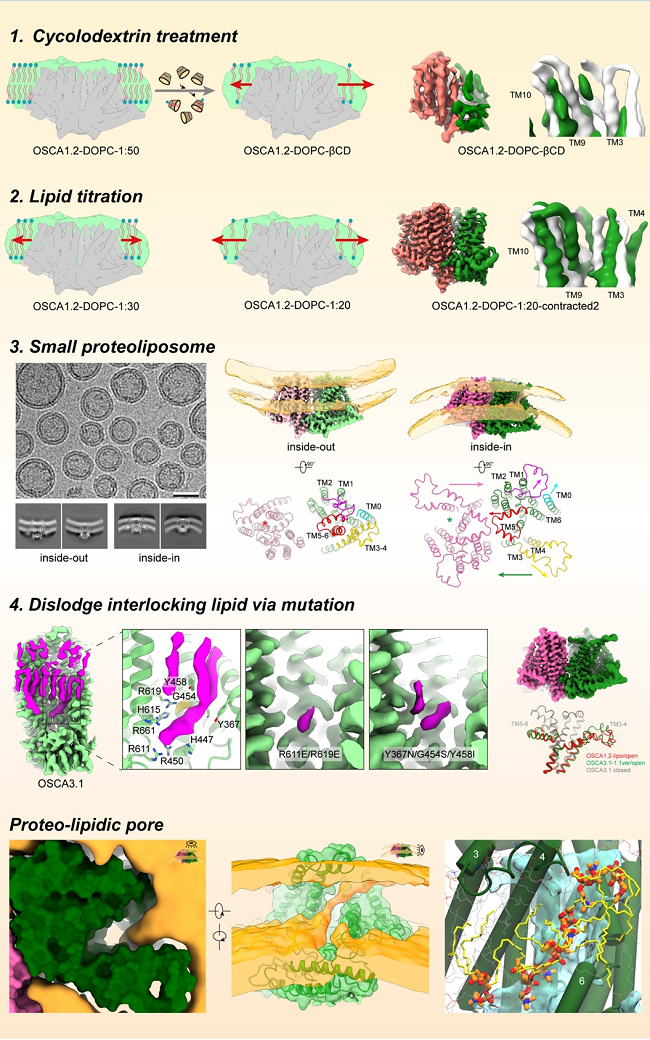
图2. 通过不同的策略捕捉OSCA蛋白激活态的三维构象并发现新的离子孔道组成形式
总的来说,本篇文章中作者通过多种策略模拟机械力环境,结合冷冻电镜、电生理、分子动力学模拟等手段,首次揭示了OSCA/TMEM63家族蛋白在机械力激活状态下一种全新的“蛋白-磷脂”离子孔道组成形式。由于OSCA/TMEM63家族蛋白与介导听觉形成的TMC1机械力敏感通道及具有离子通道和脂质翻转酶活性的TMEM16家族蛋白在结构上具有高度相似性,该研究也对这些结构相似家族蛋白的分子机制有重要提示作用。此外,该研究发展了新的基于nanodiscs的机械力环境模拟方法,同时扩展了小膜蛋白在脂质体中进行结构解析的可行性,为包括机械力通道在内的其他膜蛋白研究提供了新的思路。
中科院上海有机化学研究所生物与化学交叉研究中心博士研究生韩瑶瑶,澳大利亚Victor Chang心脏研究所博士后周子晶与澳大利亚国立大学博士后金瑞涛为本文共同第一作者。张一小研究员,Charles Cox教授与Ben Corry教授为本文共同通讯作者。上海科技大学孙亚东研究员,浙江大学杨巍教授、岳晓敏研究员,有机所交叉中心陈忠文研究员以及本文其他作者也对做出了重要贡献。该工作得到了科技部科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金海外优青项目、中科院上海分院青年英才培育计划、上海脑中心求索杰出青年项目及上海市科委的资助。
张一小研究员长期招聘细胞生物学、神经生物学、分子生物学和结构生物学方向博士后和科研助理,欢迎申请。对于优秀的博士后人选,将推荐申请中国科学院生物与化学交叉研究中心 “博士后独立PI培育”计划 (https://www.ircbc.ac.cn/view.do?id=2747)。
原文链接:
https://www.nature.com/articles/s41586-024-07256-9
参考文献
1. Yuan, F. et al. OSCA1 mediates osmotic-stress-evoked Ca2+ increases vital for osmosensing in Arabidopsis. Nature 514, 367-371 (2014).
2. Murthy, S. E. et al. OSCA/TMEM63 are an evolutionarily conserved family of mechanically activated ion channels. Elife 7, e41844 (2018).
3. Du, H. et al. The cation channel TMEM63B is an osmosensor required for hearing. Cell Rep 31, 107596 (2020).
4. Li, S. et al. Humidity response in Drosophila olfactory sensory neurons requires the mechanosensitive channel TMEM63. Nature Communications 13, 3814 (2022).
5. Yang, G. et al. TMEM63B channel is the osmosensor required for thirst drive of interoceptive neurons.” Cell discovery (2024).
6. Yang, X. et al. Structure deformation and curvature sensing of PIEZO1 in lipid membranes. Nature 604(7905):377-383 (2022).
