
-
中文 | EN

中文 | EN
发布时间:2025-02-18 00:00:00.0
阿司匹林,又称乙酰水杨酸,是一种全球范围内使用最为广泛的药物分子,长期以来被用于解热、镇痛、抗炎,以及抗血小板聚集。近年来,大量研究报道阿司匹林对癌症及衰老相关的众多疾病也具有潜在的健康益处,这也让它赢得了“神药”的美誉。尽管阿司匹林具有如此众多的临床功效,但对其作用机制的理解极其有限。因此,深入研究阿司匹林的作用机制,不仅有助于揭示其复杂的药理学机制,还可能为蛋白质功能调控提供新的见解,并发现潜在的药物靶点。这些发现将为未来新药的研发提供重要的理论依据和实践指导,具有重要的科学意义和应用价值。
中国科学院上海有机化学研究所生物与化学交叉研究中心张耀阳课题组在前期研究中,开发了DAcMS方法(PMID: 31922419),该方法结合氘同位素标记阿司匹林及乙酰化蛋白质组大规模定量分析,在炎症和肿瘤细胞中发现阿司匹林可以乙酰化数以万计的赖氨酸位点,该成果为理解阿司匹林功效机制多样化提供了重要的理论和数据基础。近日,张耀阳课题组和何凯雯课题组合作在 Nature Communications 上合作发表了一篇题为“Aspirin inhibits proteasomal degradation and promotes α-synuclein aggregate clearance through K63 ubiquitination”的研究论文。在该项研究中,研究人员进一步对阿司匹林乙酰化调控蛋白质降解相关机制展开了深入研究。

阿司匹林诱导的乙酰化主要发生在赖氨酸残基上。赖氨酸因其ε-氨基具有高化学活性,成为多种蛋白质翻译后修饰(PTM)的关键位点,尤其是乙酰化和泛素化这两种重要的修饰。这些修饰在调控蛋白质功能中扮演着多样且关键的角色,其中泛素化是蛋白质降解的主要信号。阿司匹林可以广泛诱导底物赖氨酸发生乙酰化,那么它诱导的赖氨酸乙酰化是否会干扰在赖氨酸残基上发生的泛素化,从而影响蛋白质稳定性,仍然尚不明确。
为解决这一科学问题,研究团队创新性地开发了反向脉冲SILAC标记(rp-SILAC)技术(图1),该rp-SILAC技术可以在组学层面实现系统地、定量地蛋白质降解组分析。通过结合降解组、乙酰化组和泛素化组的综合分析,研究发现阿司匹林主要通过抑制蛋白酶体活性来阻碍蛋白质降解,而非直接干扰赖氨酸的泛素化过程。此外,研究还发现阿司匹林显著增加了K63型泛素化的水平,这种泛素化类型与溶酶体介导的蛋白质聚集体降解密切相关。研究团队又进一步以帕金森病(PD)的关键病理蛋白α-突触核蛋白(α-syn)为研究对象,在细胞、原代神经元以及帕金森病模型小鼠中进行了验证。结果显示,阿司匹林能够有效降低α-syn的水平,并显著改善小鼠的运动功能。并证明这一效应是依赖于阿司匹林诱导的K63泛素化的,表明了阿司匹林诱导的K63泛素化在α-syn聚集体的清除中发挥了重要作用。
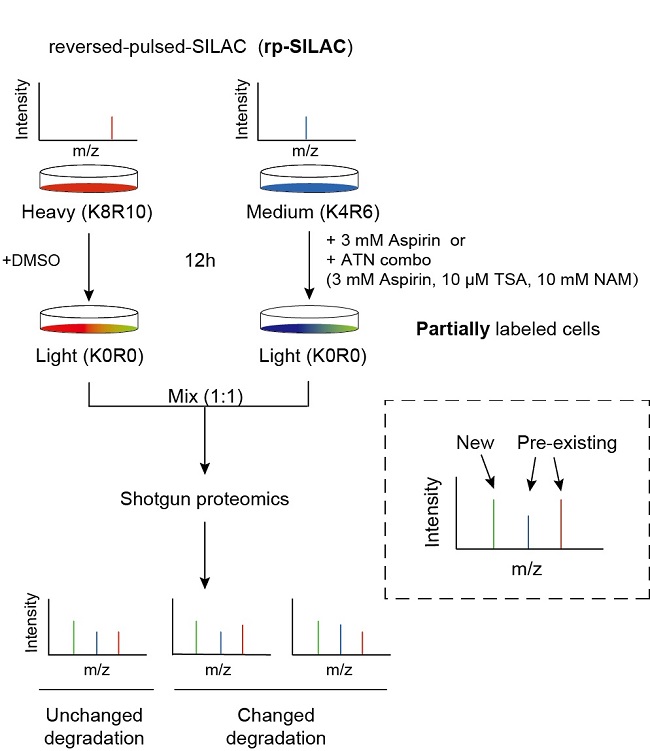
图1. rp-SILAC策略的实验方案。该策略用来系统分析蛋白质的降解。
综上,此项研究借助新开发的rp-SILAC 策略,揭示了阿司匹林在调控可溶及不可溶蛋白降解中的双重作用机制。这一发现不仅为阿司匹林调节蛋白质稳定性的机制提供了关键证据,加深了我们对该药物多样药理机制的理解,还为帕金森病等神经退行性疾病的治疗带来新的思路,为阿司匹林及相关药物的临床应用开辟了新的可能性,使其自身或相关作用通路未来有潜力成为治疗蛋白质聚集相关疾病的有效手段(图2)。
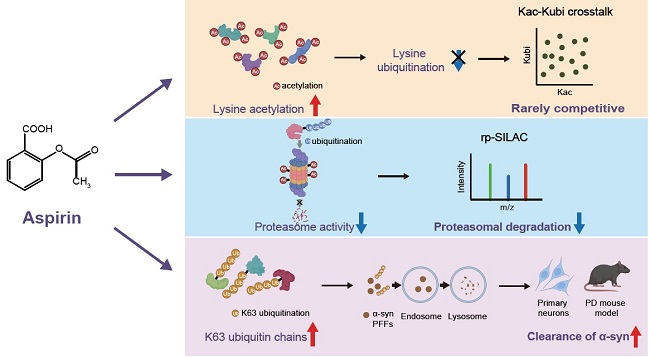
图2. 阿司匹林作用机制示意图。
中国科学院生物与化学交叉研究中心张耀阳研究员和何凯雯研究员为本文的共同通讯作者,硕士毕业生高婧和博士生刘洋为本文的共同第一作者。中国科学院生物与化学交叉研究中心许代超研究员、张在荣研究员、刘聪研究员、单冰副研究员和中国科学院昆明动物研究所的Christoph W. Turck教授等人为该工作提供了宝贵的支持和帮助。本项目得到了国家自然科学基金、中国科学院及上海市科委的基金支持。
原文链接:https://www.nature.com/articles/s41467-025-56737-6
