
-
中文 | EN

中文 | EN
发布时间:2025-07-14 00:00:00.0
β淀粉样蛋白(Amyloid-β, Aβ)淀粉样聚集被认为是阿尔茨海默病发病的核心机制之一。深入解析病理蛋白质动态相变聚集过程中的结构转变机制及其调控因子,是神经退行性疾病机制研究的重要方向。目前已有研究表明,特定的活性分子、纳米组装体或多肽可干预Aβ等淀粉样蛋白的聚集路径,从而影响其聚集体构象及病理毒性。然而,已有的研究大多基于抑制聚集、阻断毒性寡聚中间体形成的思路。反其道而行之,通过活性分子诱导促进病理蛋白形成低毒性稳定聚集体的研究较少。糖基化作为一种普遍存在于哺乳动物蛋白质的重要翻译后修饰,因其在稳定蛋白质构象与调节分子相互作用中所发挥的关键作用,近年来受到广泛关注。探索糖基化多肽调控蛋白聚集行为的分子机制,具有重要科学意义和潜在临床应用价值。
近日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员团队联合北京大学药学院天然药物及仿生药物全国重点实验室董甦伟教授团队及北京大学化学与分子工程学院刘源/王初教授团队,在Nature Communications杂志在线发表题为“An O-glycopeptide participates in the formation of distinct Aβ42 fibril structures and attenuates Aβ42 neurotoxicity”的研究论文。该研究发现,特定结构的酪氨酸O-糖修饰多肽可与β淀粉样多肽Aβ42协同组装,诱导其加速形成全新的淀粉样纤维结构,从而显著减少毒性寡聚体的累积并缓解神经毒性。该工作系统探究了糖肽调控淀粉样蛋白聚集的分子机制,首次解析了Aβ42-糖肽共组装纤维的冷冻电镜结构,为淀粉样蛋白聚集相关疾病干预策略的开发提供了新的思路。

在该工作中,研究团队以Aβ聚集核心片段Gly9-Ala21为模板,设计合成了一系列10位酪氨酸O-糖基化的多肽,涵盖多种单糖结构及不同糖苷键构型,用以探究糖肽对Aβ42聚集过程的影响。通过筛选发现:修饰有β-N-乙酰氨基半乳糖(β-GalNAc)的糖肽能够显著促进Aβ42单体聚集形成纤维、降低毒性寡聚体的累积(图一),提示其可能引导Aβ42向低毒性聚集体转化。
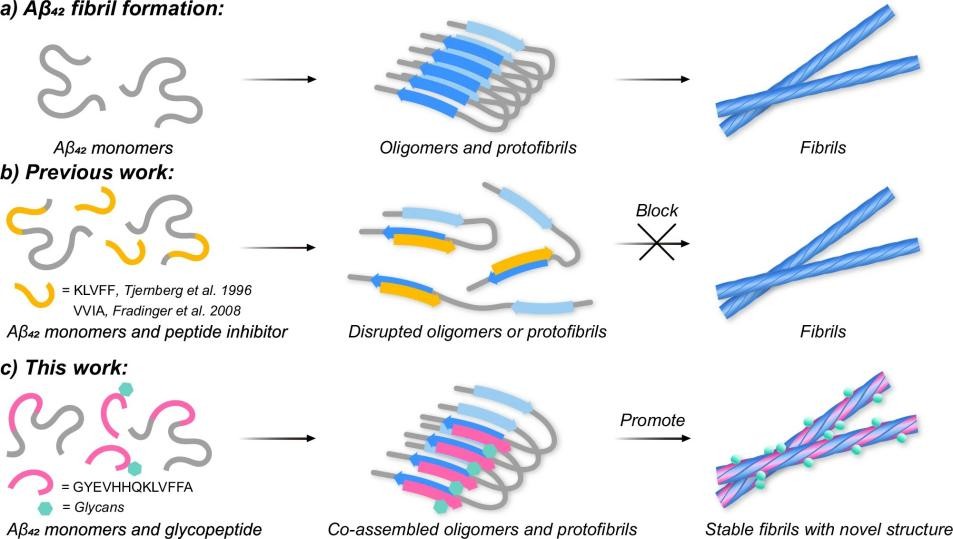
图一、Aβ42聚集及其调控策略示意(来源:Nature Communications)
为阐明糖肽促Aβ聚集效应的分子机制,研究团队运用冷冻电镜技术成功解析了糖肽与Aβ42共组装形成的三种全新纤维结构(图二),这些结构均具有清晰的螺旋参数和β-折叠核心,并展现出与Aβ42单独聚集形成纤维相比更多的疏水作用区域,以及更紧密的分子堆积,表明糖肽可深度介入并重塑Aβ42的聚集路径。通过Rosetta结构建模与分子动力学模拟,研究者进一步揭示了糖肽能通过其β-GalNAc中酰胺的N-H与相邻层β-GalNAc的4位直立羟基形成稳定的氢键网络,增强了聚集单元之间的相互作用,从而稳定了新形成的纤维结构。
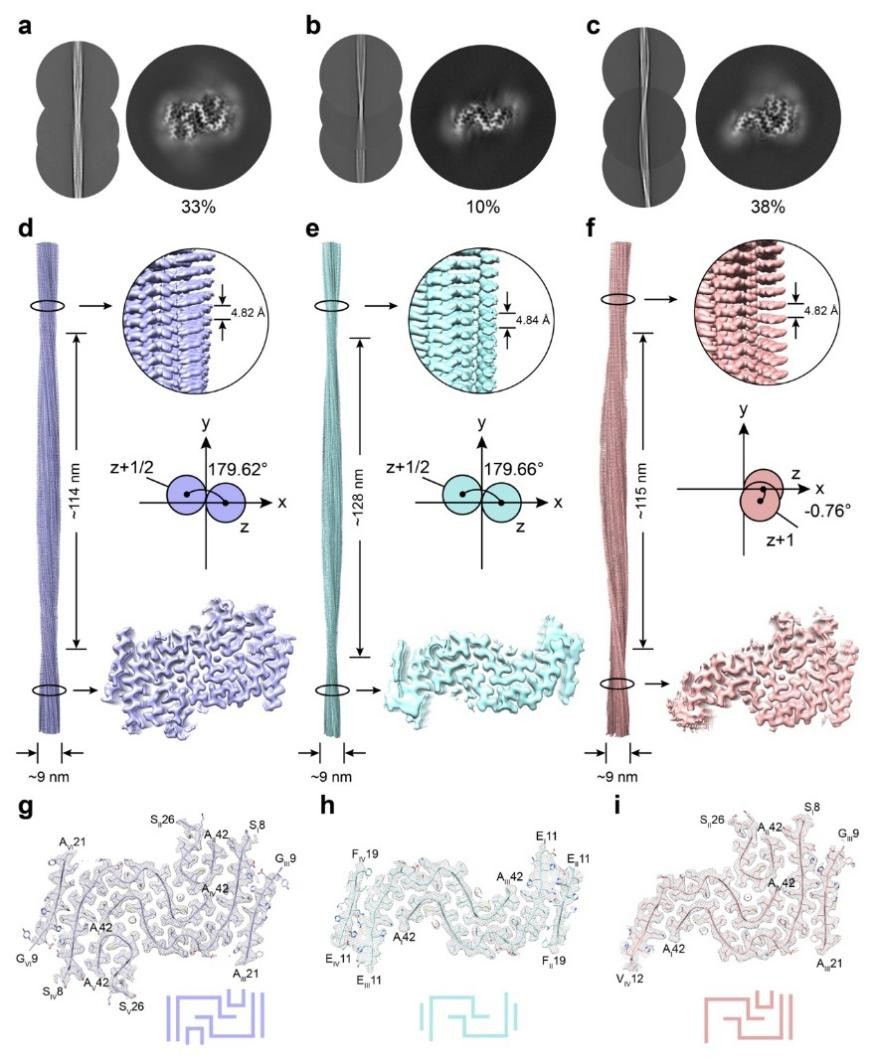
图二、三种新型Aβ42-糖肽共组装纤维的冷冻电镜结构(来源:Nature Communications)
功能实验方面,该糖肽在神经元细胞模型中显著降低了Aβ42的细胞毒性,并在阿尔茨海默病模型小鼠中展示出改善了转基因鼠认知功能与神经病理表现的效果。该结果不仅验证了糖肽在细胞系和小鼠体内的神经保护作用,也为“促聚解毒”的蛋白质病理聚集调控策略提供了实验数据支持。
综上,该工作通过糖肽设计合成、三维结构解析、分子动力学模拟和生物学功能评估相结合,系统研究并揭示了O-糖肽在调控Aβ42聚集和毒性过程中的结构基础与作用机制,提出了糖基化修饰多肽可引导Aβ形成结构更稳定、毒性更低的纤维聚集体的新思路,也展示了糖肽类分子作为调控淀粉样蛋白聚集新结构类型的潜力。
北京大学药学院董甦伟教授、中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员以及北京大学化学学院刘源研究员为论文共同通讯作者。北京大学药学院2022届硕士毕业生魏琦佳、刘当亮,中国科学院上海有机化学研究所生物与化学交叉研究中心2025届博士毕业生夏文程,北京大学化学学院2025届博士毕业生王冯璋为该论文的共同第一作者。本研究工作得到了国家自然科学基金项目、上海市科委、上海尚思自然科学研究院项目及中国科学院项目的大力支持。
论文链接:https://www.nature.com/articles/s41467-025-60978-w
