Cell Reports | 刘聪与合作者开发靶向帕金森病α-syn病理聚集体的单克隆抗体
帕金森病(Parkinson's disease, PD)是全球第一大运动障碍性神经退行性疾病,主要病理特征为神经元内含有α-突触核蛋白(α-synuclein, α-syn)淀粉样纤维聚集体的路易小体/路易神经突形成,并伴有神经炎症反应。目前,PD的治疗主要依赖多巴胺递送和深部脑刺激等方法,虽能缓解运动症状并改善患者生活质量,但无法减缓疾病进程。近年来,靶向病理性α-syn聚集体的单克隆抗体治疗,作为一种潜在的疾病修饰策略,因其强亲和力和高特异性,受到广泛关注1-3。病理性α-syn聚集体可与神经元和小胶质细胞膜上的受体结合,介导其细胞间传播,诱发神经炎症并干扰自噬过程,从而加重神经损伤。近年来,刘聪课题组聚焦于α-syn与受体蛋白的相互作用,鉴定并表征识别α-syn病理性纤维的多种关键受体并阐释其互作的分子机制,发现α-syn纤维的无序C末端是多类受体识别的关键区域4-7。因此,通过抗体特异性靶向这一区域来阻断α-syn纤维与受体的相互作用,为PD药物的研发提供了新的思路。

2026年1月22日,中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪、上海交通大学李丹及迈威生物刘大涛团队合作在Cell Reports期刊上发表了题为“A monoclonal antibody targeting the C-terminal of α-synuclein fibrils mitigates pathology in a Parkinson’s disease model”的研究论文。该研究采用人源α-syn预制纤维(Preformed fibrils, PFFs)作为免疫抗原对小鼠进行免疫,建立了一套整合体外筛选与神经元功能验证的多层级筛选策略,最终,从上万个克隆中筛选出最具潜力的候选单克隆抗体H21。进一步,研究团队在体外水平上对H21与α-syn的结合、在细胞水平和小鼠体内水平上对其减轻α-syn病理的效果进行了详细表征,并揭示了其相互作用的分子机制。
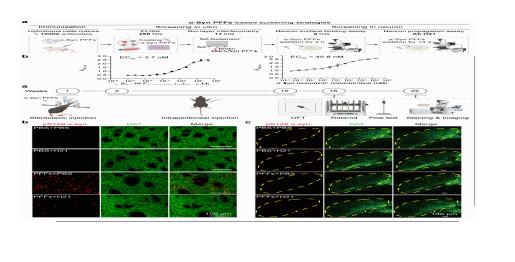
图1 通过建立多级筛选系统获得特异性识别α-syn 病理性聚集体的单克隆抗体H21
在本项工作中,研究团队综合运用PD细胞模型和小鼠模型,并结合多种结构生物学方法(包括NMR、cryo-EM、cryo-ET及基于AlphaFold 3的结构预测),深入阐释了抗体H21与α-syn纤维相互作用的分子机制,并揭示了其在抑制α-syn病理毒性中的作用模式。研究结果表明:1)H21选择性结合α-syn纤维,其与纤维的亲和力高达3.7 nM,是单体亲和力的10倍以上;2)结合表位位于α-syn纤维的C端131-140氨基酸残基;3)H21沿α-syn纤维轴呈周期性分布,并诱导纤维构象发生显著变化;4)H21能够竞争性抑制并有效阻断α-syn纤维与多种已知受体蛋白的结合;5)H21治疗可显著减少PD小鼠中病理性α-syn聚集体的传播,减轻神经炎症反应,并缓解运动功能障碍。
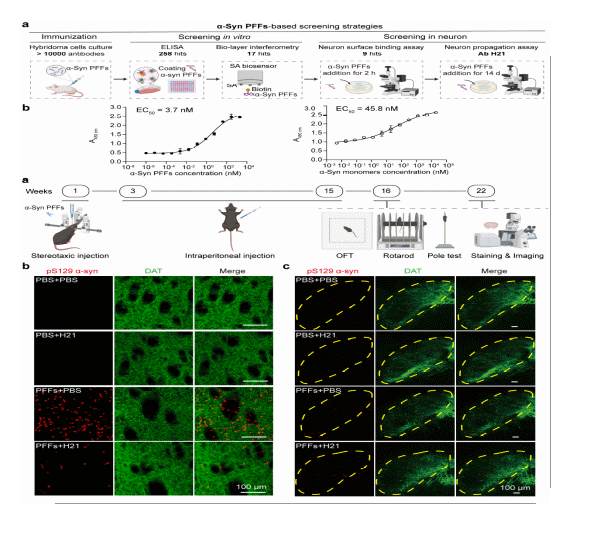
图2 抗体H21显著减少PD小鼠中的病理性α-syn聚集
综上,本研究筛选出特异性靶向α-syn病理纤维C端的单克隆抗体H21,并揭示了其与α-syn纤维相互作用的分子机制,以及阻断α-syn纤维病理传播和炎症反应的作用机制。此外,本研究中建立的基于体外筛选和神经元功能验证的筛选策略,未来有望用于靶向其他淀粉样纤维的单克隆抗体筛选。H21展现出的潜在治疗效果,为其向临床应用的推进提供了基础,或为PD的治疗带来新的可能性。
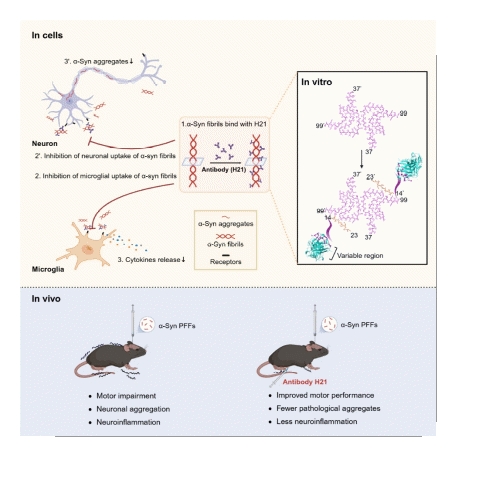
图3 H21特异性结合α-syn纤维的酸性C末端并诱导纤维构象发生改变,阻断其与细胞膜受体的相互作用,进而抑制由α-syn纤维引发的神经元病理性聚集、神经炎症等病理过程,减轻PD相关病理。
中国科学院上海有机化学研究所生物与化学交叉研究中心刘聪研究员、上海交通大学Bio-X研究院及张江高等研究院李丹教授,以及迈威生物刘大涛博士为共同通讯作者。上海交通大学Bio-X研究院2022级博士研究生曾姝怿、刘聪课题组副研究员张胜男博士、迈威生物桂勋博士、刘聪课题组博士后李丹妮,以及刘聪课题组2025届博士毕业生吕适然为该论文的共同第一作者。本研究工作得到了国家自然科学基金、上海市科委、上海尚思自然科学研究院项目及中国科学院项目的大力支持。
原文链接:https://www.cell.com/cell-reports/fulltext/S2211-1247(25)01669-9
参考文献:
1. Pagano, G. et al. Prasinezumab slows motor progression in rapidly progressing early-stage Parkinson's disease. Nat Med30, 1096-1103 (2024).
2. Pagano, G. et al. Sustained effect of prasinezumab on Parkinson's disease motor progression in the open-label extension of the PASADENA trial. Nat Med30, 3669-3675 (2024).
3. Buur, L. et al. Randomized Phase I Trial of the α-Synuclein Antibody Lu AF82422. Mov Disord39, 936-944 (2024).
4. Zhang, S. et al. Mechanistic basis for receptor-mediated pathological α-synuclein fibril cell-to-cell transmission in Parkinson's disease. Proc Natl Acad Sci U S A118(2021).
5. Xu, Q. et al. α-Synuclein amyloid fibril directly binds to LC3B and suppresses SQSTM1/p62-mediated selective autophagy. Cell Res35, 72-75 (2025).
6. Wu, K.M. et al. Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson's disease. Science387, 892-900 (2025).
7. Long, H. et al. Interaction of RAGE with α-synuclein fibrils mediates inflammatory response of microglia. Cell Rep40, 111401 (2022).
附件下载:

