
-
中文 | EN

中文 | EN
1. 程序性细胞死亡检查点的发现及其失活导致人类疾病的分子机制
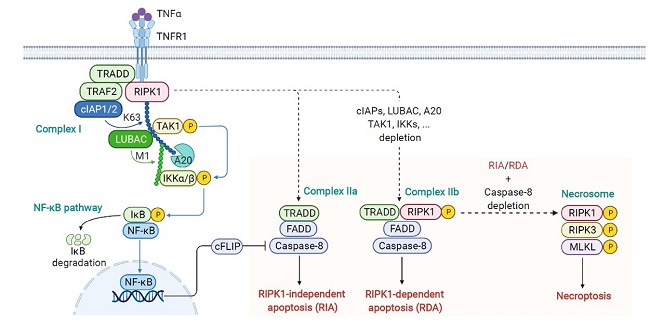
细胞死亡和炎症是人类疾病的共性机制。生理情况下,细胞死亡和炎症具有维持稳态、免疫监视和抵抗感染的功能。疾病情况下,细胞死亡和炎症被过度激活,两者相互促进,导致一系列疾病的发生。正常情况下,细胞死亡受到严密的调控,称之为细胞死亡检查点(Cell-death checkpoints)。以死亡受体TNFR1介导的程序性死亡为例,我们过去的工作鉴定出了多个新的死亡检查点,并揭示了检查点失活导致人类疾病的分子机理。我们发现的TBK1检查点通过对RIPK1的磷酸化作用抑制其激活导致的细胞凋亡和小鼠胚胎死亡,同时还揭示了TBK1检查点突变与衰老协同作用导致RIPK1激活促进渐冻症ALS的分子机制(Cell, 2018)。我们发现的SENP1检查点通过对RIPK1的去SUMO化修饰抑制了细胞凋亡和脂肪性肝炎的发生,揭示了非酒精性脂肪肝炎中肝细胞死亡和炎症的发生机制(Nat Commun, 2022)。我们发现的程序性坏死检查点PARP5A和RNF146通过对RIPK1的PARdU修饰限制了细胞坏死,并揭示了PARP5A和RNF146通过共相分离的形式调控程序性坏死的分子机制(Mol Cell, 2024)。目前实验室已建立起多种基因和小分子筛选策略,致力于揭示更多新的细胞死亡检查点及其失活导致人类疾病的分子机制。
2. 炎性细胞死亡通路中关键蛋白的生物化学研究及其生理/病理功能
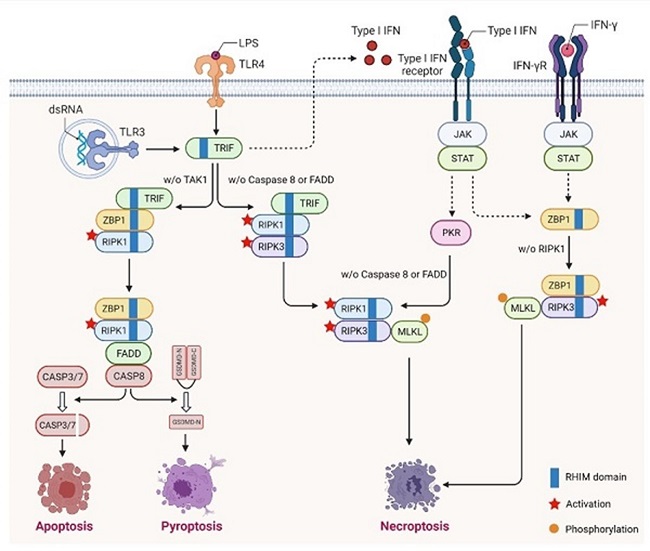
炎性细胞死亡包括程序性坏死、焦亡等,其中的核心蛋白已经被发现可以受多种蛋白翻译后修饰的调节。例如,我们之前的研究鉴定了RIPK1上的新型磷酸化位点,并发现了相应的磷酸激酶AMPK,证明了AMPK-RIPK1轴在能量稳态失调促进细胞死亡中的重要作用(Science, 2023)。此外,我们还鉴定出RIPK1上的羟基化位点,揭示了缺氧通路在氧气匮乏情况下协调细胞存活与死亡的重要分子机制(Nat Cell Biol, 2023)。细胞焦亡在细菌免疫中发挥重要作用。我们的工作还发现了AMPK对RIPK1的磷酸化作用在叶尔森式菌感染的情况下因为葡萄糖和能量水平的大幅下降而被激活,使得细胞焦亡被抑制,促进了叶尔森式菌的感染,揭示了临床上采用充足营养补给帮助病人抵抗细菌感染背后的生物学机制(Nat Microbiol, 2024)。目前实验室采用多重蛋白质谱技术鉴定出RIPK1等蛋白发生的各种新的修饰类型,并发现负责这些修饰的酶类,未来将通过采用遗传学实验对酶与RIPK1等蛋白之间的关系进行阐述,揭示RIPK1等蛋白新的生理和病理功能。
3. 新型细胞死亡通路的发现及其病理功能
目前明确的程序性细胞死亡主要包括细胞凋亡、程序性坏死、焦亡等。在特定情况下,经典的细胞死亡往往会以非经典通路的形式发生。例如早期认为程序性坏死由RIPK1介导,后来发现ZBP1也可以介导。程序性细胞死亡的形态特征以质膜破裂和细胞核肿胀为特征,细胞核保持相对完整。在经典的程序性细胞死亡中,鲜有核膜破裂的现象。是否存在以核膜破裂为特征的程序性坏死通路是领域内的空白。我们最近的一项研究发现了一种“细胞核程序性坏死”通路,首次报道了毒性蛋白Prelamin A驱动的发生在细胞核内的细胞坏死通路,并证明该通路的激活导致细胞核膜的破裂和DNA的泄露,最后引起细胞死亡和炎症。重要的是,我们通过遗传学实验证明这种细胞核坏死是驱动以Prelamin A累积为特征的早衰疾病的重要原因(Nat Cell Biol, 2024)。实验室将继续着力于揭示非经典的细胞死亡通路,并研究其在人类疾病中的重要作用,为复杂疾病的干预明确治疗的新手段。
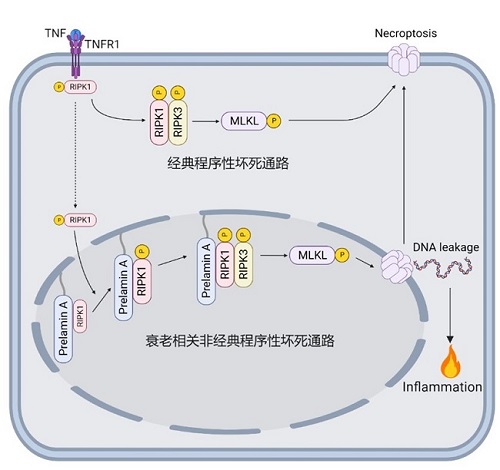
图3
4. 衰老向神经退行性疾病演化的分子机理和药物开发
衰老是人类疾病如神经退行性疾病的首要风险因素。目前常用的模型动物,如线虫,果蝇,小鼠等,它们在寿命以及生存环境上与人类差距巨大,因此很大程度上模式动物难以真正模拟人类的衰老。我们从人类衰老的特性出发,以人类脑衰老样本为对象,鉴定出了人类衰老中特异改变的蛋白组,并分别研究各个蛋白在人类衰老向疾病演化,尤其是向阿尔茨海默症演化中的作用。相关研究中,我们发现蛋白激酶TAK1在人类大脑中随着衰老降低,其减少可以模拟衰老引起的致敏环境,并为ALS的发生提供了协同促进作用(Cell, 2018)。此外,我们揭示了脑衰老引起细胞稳态下调的分子机制,通过遗传学实验揭示了DHHC5介导的BENC1棕榈酰化减少是脑衰老导致细胞自噬水平降低和细胞稳态水平下降以及促进阿尔茨海默症的根本原因(Nat Struct Mol Biol, 2024)。抑制神经元死亡和促进细胞稳态恢复是目前公认的治疗神经退行性疾病的两个重要策略。实验室创新性的采用多重细胞死亡模型以及细胞稳态模型,进行小分子化合物的筛选,发现了可以同时抑制细胞死亡和恢复细胞稳态的小分子先导药物Apostatin-1,并鉴定出其作用靶点TRADD,证明了其在干预神经退行性疾病中的巨大潜力(Nature, 2020)。实验室将继续基于细胞死亡和炎症的调控机制开发新的小分子药物策略,通过鉴定新的疾病靶点,重点研究针对阿尔茨海默症的药物干预手段。
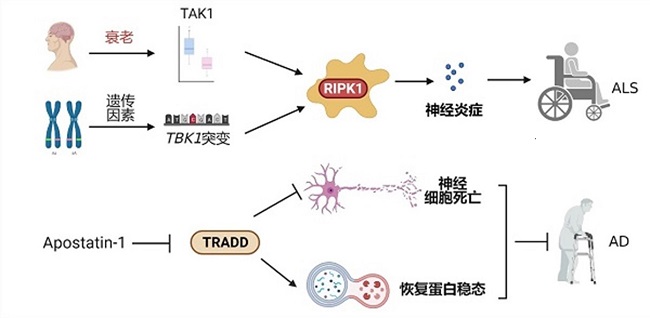
图4
